Là một rối loạn đặc trưng bởi tình trạng viêm mãn ở gan kéo dài ít nhất 6 tháng
TỔNG QUAN
NGUYÊN NHÂN
Viêm gan virus B (HBV), viêm gan virus C (HCV), viêm gan virus D (HDV delta agent), thuốc (methyldopa, nitrofurantoin, isoniazid, dantrolene), thuốc, viêm gan tự miễn, bệnh Wilson, hemochromatosis, thiếu α1-antitrypsin.
PHÂN LOẠI MÔ HỌC
Viêm gan mãn tính có thể phân loại theo mức độ và giai đoạn. Mức độ đánh giá mô hoặc hoạt động viêm và hoại tử dựa trên sinh thiết gan. Gai đoạn viêm gan mãn tính phản ánh mức độ tiến triển của bệnh và dựa trên mức độ xơ hóa (xem Bảng 306-2, p. 2568, HPIM-18).
BIỂU HIỆN
Hình ảnh lâm sàng trải rộng từ không có triệu chứng gì aminotransferase huyết tăng tới các biểu hiện cấp tính, thậm chí viêm gan tối cấp. Các triệu chứng phổ biến gồm mệt mỏi, khó chịu, chán ăn, sốt nhẹ; vàng da thường khi bệnh nặng. Một số bệnh nhân có xuất hiện các biến chứng xơ gan : cổ trướng, dãn tĩnh mạch chảy máu, bệnh lý não, và lách to. Trong HBV hoặc HCV mãn và viêm gan tự miễn, có thể chủ yếu là các biểu hiện ngoài gan
VIÊM GAN B MÃN TÍNH
Chỉ có khoảng 1-2% trường hợp viêm gan B cấp tính ở người có miễn dịch bình thường; thường ở người suy giảm miễn dịch. Phổ bệnh, không có triệu chứng, viêm gan mãn tính, xơ gan, ung thư biểu mô tế bào gan;
giai đoạn sớm thường gắn liền với triệu chứng viêm gan
Tăng aminotransferase, xuất hiện HBeAg và HBV DNA huyết, dạng nhân lên của HBV trong gan; ở giai đoạn muộn hơn ở một số bệnh nhân có thể có cải thiện lâm sàng và hóa sinh, HBeAg và HBV DNA biến mất và xuất hiện anti-HBeAg huyết, và tích hợp HBV DVA vào gen tế bào chủ ở gan. Ở vùng Địa Trung Hải và các quốc gia châu Âu cũng như Châu Á, dạng biến thường gặp biểu hiện là dễ dàng phát hiện HBV DNA, nhưng không có HBeAg (anti- HBeAg- phản ứng). Phần lớn các trường hợp do đột biến vùng pre-C trên gen HBV làm ngăn cản tổn hợp HBeAg (có thể xuất hiện ở trường hợp nhiễm HBV mãn tính type hoang dại do ức chế miễn dịch và có thể giải thích một bài trường hợp viêm gan B tối cấp. Viêm gan B mãn tính cuối cùng dẫn đến xơ gan trong 25-40% trường hợp (chủ yếu ở người bội nhiễm H/dv hoặc đột biến pre-C) và ung thư biểu mô tế bào gan xuất hiện nhiều trong các bệnh nhân này (chủ yếu người mắc khi còn nhỏ)
BIỂU HIỆN NGOÀI GAN ( PHÚC HỢP MIỄN DỊCH – TRUNG GIAN)
Phát ban, nổi mề đay, viêm khớp, viêm mạch giống viêm đa động mạch dạng nốt, rối loạn đa thần kinh, viêm cầu thận
ĐIỀU TRỊ Viêm Gan B Mãn Tính
Có 7 loại thuốc được phê duyệt trong điều trị HBV mãn :interferon α (IFN-α), pegylated interferon (PEG IFN), lamivudine, adefovir dipivoxil, entecavir, telbivudine, and tenofovir ( xem Bảng 164-1). Sử dụng IFN-α dần được thay thế bằng PEG-IFN. Bảng 164-2 tóm tắt các khuyến cáo điều trị HBV mãn tính
VIÊM GAN C MÃN TÍNH
50 -70% trường hợp liên quan đến truyền máu và nhiễm HCV lẻ tẻ. Biểu hiện lâm sàng nhẹ, thường mức độ tăng aminotransferase suy yếu dần; viêm gan mãn tính nhẹ trên sinh thiết gan. Các biểu hiện ngoài gan bao gồm cryoglobuline huyết, rối loạn chuyển hóa porphyria biểu hiên da muộn triệu chứng, viêm cầu thận tăng sinh màng, viêm tuyến nước bọt lympho. Chuẩn đoán xác định bằng phát hiện anti- HCV huyết. Có thể dẫn đến xơ gan trong ≥20% sau 20 tuổi.
ĐIỀU TRỊ Viêm gan C mãn tính
Điều trị nên được cân nhắc ở bệnh nhân phát hiện HCV RNA huyết và bằng chứng sinh thiết gan viêm gan mãn tính mức độ trung bình( xơ vùng quanh tĩnh mạch cửa). Các chất hiện nay được sử dụng điều trị HCV mãn tính, liều lượng và thời gian phụ thuộc vào kiểu gen HCV (Xem Bảng 164-3 và Bảng 164-4). Bệnh nhân có kiểu gen typ 1, PEG IFN/ ribavirin nên được kết hợp với ức chế protease (boceprevirm tela- previr) nếu có. Không nên dùng đơn độc ức chế protease do tăng kháng thuốc. Do hiện nay các chất ức chế protease HCV sẵn có chưa được nghiên cứu trên bệnh nhân nhiễm HCV khác các type khác, sử dụng chúng cho các type này chưa được khuyến cáo ( xem bảng 164-3)
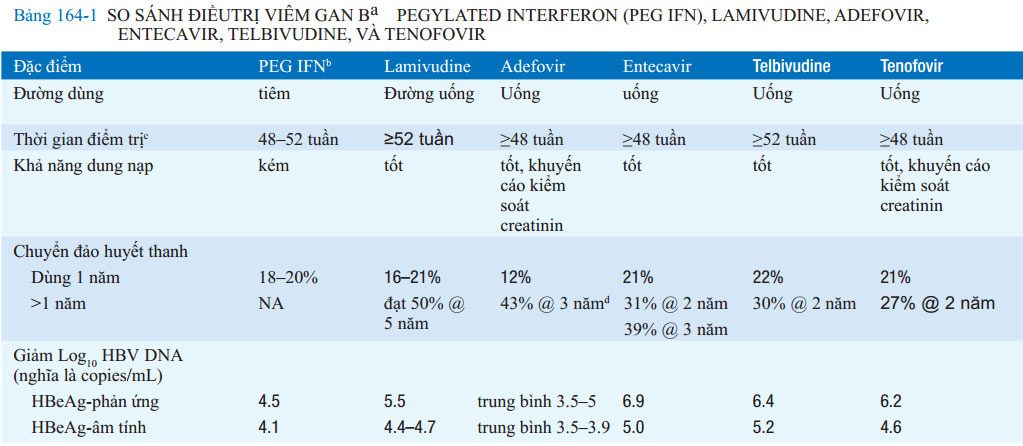
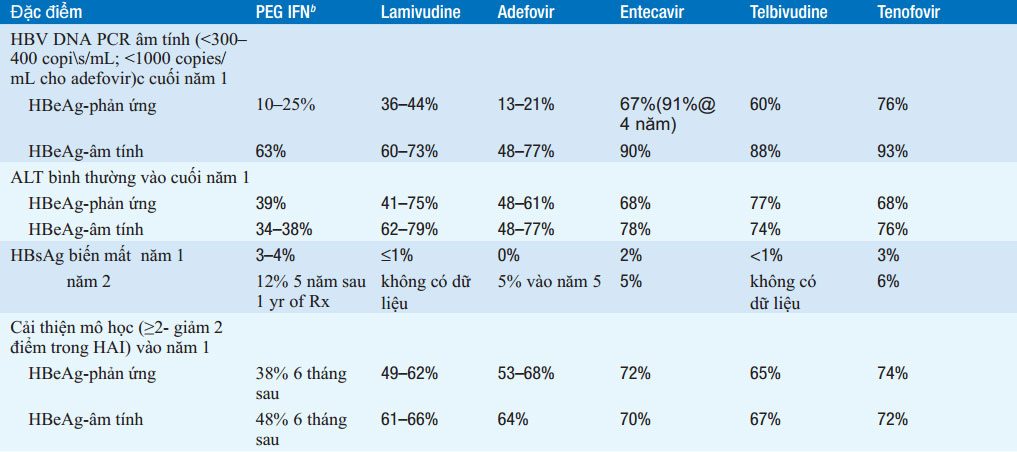

a Nói chung, những so sánh này dựa trên mỗi thử nghiệm lâm sàng riêng biệt so với các thuốc giả dược (placebo) trong các thử nghiệm lâm sàng được đăng ký; trong các trường hợp ngoại lệ hiếm gặp, những so sánh này không dựa trên các thử nghiệm các thuốc này từ đầu, các ưu điểm và nhược điểm nên được giải thích cẩn thận
b Mặc dù IFN-α dùng hằng ngày hoặc 3 lần một được được phê duyệt trong điều trị viêm gan B, nó đã dần được thay thế bằng PEG IFN, nó được dùng một lần một tuần và hiệu quả hơn. IFN tiêu chuẩn không có ưu điểm hơn PEG IFN.
c Thời gian điều trị trong các thử nghiệm lâm sàng hiệu quả; sử dụng trong thực hành lâm sàng có thể thay đổi
d Do lỗi ngẫu nhiên do máy tính tạo ra do sự phân bố không đều của các thuốc giả dược trong suốt năm thư hai của điều trị lâm sàng thử nghiệm, tần số chuyển đổi huyết thanh HBeAg vượt xa trong năm đầu tiên, ước tính ( phân tính (kaplan-Meier analysis) dựa trên các tập con nhỏ của adefovir được thực hiện chính xác
e7% trong suốt một năm điều trị (43% vào năm 4) ở các bệnh nhân kháng lamivudine
f~17,400 bệnh nhân khó điều trị lamivudine
Viết tắt: ALT, alanine aminotransferase; HAI, chỉ số hoạt động mô học; HBeAg, kháng nguyên e; HBsAg, kháng nguyên bề mặt; HBV, viêm gan virus B; NA, không dùng; PEG IFN, pegylated interferon; PCR, polymerase chain reaction; Rx, điều trị; yr, năm.
BẢNG 164-2 KHUYẾN CÁO ĐIỀU TRỊ VIÊM GAN Ba RE MÃN TÍNH
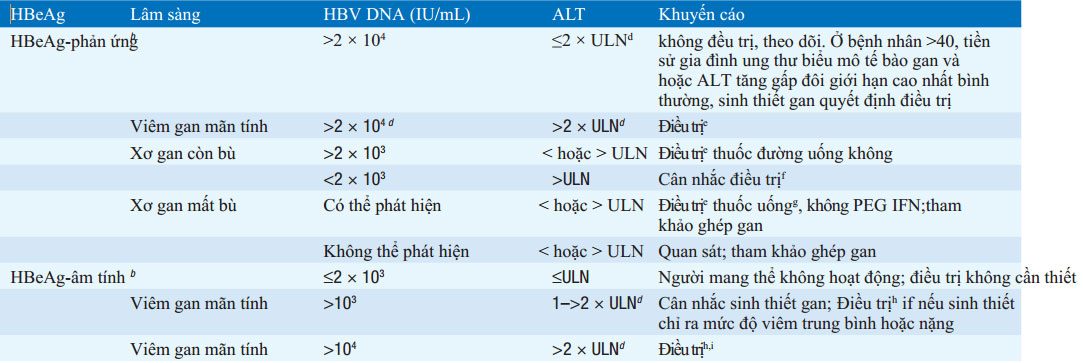
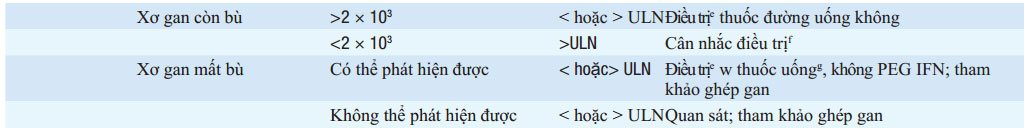
Dựa trên hướng dẫn hội nghiên cứu bệnh gan của Mỹ (AASLD). Trừ phần chú thích, các hướng dẫn tương tự như các hướng dẫn của hội nghiên cứu bệnh gan
Châu Âu (EASL)
b Bệnh gan có xu hướng nhẹ hoặc không hoạt động trên lâm sàng, phần lớn các bệnh nhân này không cần sinh thiết gan
cMô hình phổ biến trong suốt thập liên đầu ở bệnh nhân Châu Á nhiễm từ lúc mới sinh
dTheo hướng đẫn của EASL điều trị nếu HBV DNA >2 × 103 IU/mL và ALT >ULN.
e Một trong các thuốc đường uống mạch có hàng rào đề kháng cáo (entecavir hoặc fenofovir) hoặc PEG IFN có thể được sử dụng như một liệu pháp đầu tiên (xem văn bản). Những loại thuốc uống, không pải PEG IFN, nên được sử dụng ở bệnh nhân kém dung nạp và suy giảm miễn dục/ IFN- khó điều trị.PEG IFN được tiêm hằng tuần bằng SC trong 1 năm. Các thuốc uống dùng hằng ngày trong ít nhất một năm, hoặc tiếp tục suốt đời hoặc ít nhất 6 tháng sau chuyển đổi HBeAg
Theo hướng dẫn của EASL, bệnh nhân xơ gan mất bù và có thể phát hiện HBV DNA ở bất kì mức độ nào, thậm chí ALT bình thường, đều nên điều trị. Phần lớn, các tác giả cho rằng nên điều trị vĩnh viễn, thậm chí trong trường hợp HBeAg- dươg tính sau chuyển đổi huyết thanh HBeAg
g— Do kháng thuốc làm mất khả năng chống virus và sơ gan mất bù trở lên xấu hơn, phác đồ điều trị ít kháng thuốc được khuyến cáo là entecavir hoặc
tenofovir đơn điều trị hoặc phối hợp với các thuốc dễ kháng thuốc lamivudine (hoặc telbivudine) cộng adefovir. Điều trị nên được tiến hành khẩn trương.
hDo chuyển đổi huyết thanh HBeAg không phải là một lựa chọn, mục tiêu điều trị là loại bỏ HBV DNA và duy trì ALT bình thường. PEG IFN tiêm mỗi tuần trong một năm, thân trọng, tùy thuộc vào sau điều trị 6 tháng để xác nhận đáp ứng bền vững, vì phần lớn các đáp ứng thường mất đi sau đó. Các thuốc uống enteca-vir hoặc tenofovir, dùng hằng ngày thường suốt đời, tận khi có đáp ứng sinh hóa và virus rất hiếm xuất hiện và kèm theo có chuyển đổi huyết thanh. Bệnh nhân lớn tuổi và xơ gan tiến triển, cân nhắc hạ ngưỡng HBV DNA đế >2 × 103 IU/mL.
Viết tắt: ALT, alanine aminotransferase; AASLD : hội nghiên cứu bệnh gan Mỹ; EASL, Hội nghiên cứu về gan Châu Âu; HBeAg, Kháng nguyên e;
HBsAg, kháng nguyên bề mặt; HBV, virus viêm gan B; PEG IFN, pegylated interferon; ULN, giới hạn trên bình thường.
BẢNG 164-3 PEGYLATED INTERFERON α-2A VÀ α-2B TRONG VIÊM GAN C MIỄN TÍNH
| PEG IFN α-2b | PEG IFN α-2a | |
| kích thước PEG Thời gian bán thải Độ thanh thải Liều Bảo quản |
12 kDa thẳng 54 h 725 mL/h 1.5 μg/kg (dựa-cân nặng) nhiệt độ phòng |
40 kDa nhánh 65 h 60 mL/h 180 μg Tủ lạnh |
| Ribavirin liều | ||
| Genotype 1 Genotype 2/3 |
800–1400 mga 800 mg |
1000–1200 mgb 800 mg |
| Thời gian điều trị | ||
| Genotype 1c Genotype 2/3 Hiệu quả điều trị kết hợpe Genotype 1c Genotype 2/3 |
48 tuần 48 tuầnd 54% 40–42% 82% |
48 tuần 24 tuần 56% 41–51% 76– 78% |
aTrong các thử nghiệm PEG IFN α-2b với ribavirin, phác đồ tối ưu là 1.5 μg PEG IFN với 800 mg ribavirin; tuy nhiên các phân tích sau nghiên cứu chỉ ra rằng liều ribavirin cao hơn
thì tốt hơn. Trong các thử nghiệm tiếp theo PEG IFN α-2b với ribavirin ở bệnh nhân genotype 1, liều ribavirin hằng ngày sau đã được kiểm định : 800 mg với bệnh nhân <65 kg,
1000 mg với bệnh nhân >65–85 kg, 1200 bệnh nhân >85–105 kg, and 1400 mg bệnh nhân >105 kg.
b1000 mg bệnh nhân <75 kg; 1200 mg bệnh nhân ≥75 kg.
cDựa trên phác đồ PEG IFN/ribavirin không kháng protease
dTrong các thử nghiệm PEG IFN α-2b với ribavirin, tất cả bệnh nhân được điều trị trong 48 h; tuy nghiên dữ liệu từ các thử nghiệm khác về IFNs tiêu chuẩn và PEG IFN chứng minh rằng 34 tuần là đủ cho bệnh nhân genotypes 2 và 3. Đối bệnh nhân genotype 3, xơ gan tiến triển/ xơ gan và/ hoặc HCV RNA cao, điều trị đủ 48 tuần
e Những lỗ lực so sánh 2 chế phẩm PEG IFN dựa trên các kết quả thử nghiệm lâm sàng bị làm sai do sự khác nhau của 2 thử nghiệm về phương pháp chi tiết ( liều ribavirin khác nhau, khác nhau về phương pháp ghi đáp ứng, và các tác dụng phụ) và nghiên cứu thành phần dân số ( tỉ lệ khác nhau cầu xơ (bridging fibrosis)/ xơ gan, tỉ lệ Hoa kì so với quốc tế, cân nặng trung bình, tỉ lệ genotype 1, và tỉ lệ HCV RNA cao). Trong so sánh từ đầu hai chế phẩm PEG IFN trong thử nghiệm IDEAL được báo cáo trong 2009, 2 chế phẩm được so sánh về khả năng dung nạp và hiệu quả. PEG IFN α-2b dùng hằng tuần liều phụ thuộc cân nặng 1.0 μg/kg hoặc 1.5 μg/kg, và PEG IFN α-2a dùng hằng tuần với liều cố định 180 μg. Trong PEG IFN α-2b, ribavirin dùng hằng ngày liều phụthuộc cân nặng giới hạn từ 800–1400 mg dựa trên các tiêu chí cân nặng,a trong khi PEG IFN α-2a, ribavirin dùng hằng ngày liều phụ thuộc cân
nặng giới hạn từ 1000 và 1200 mg.bTrong nhóm nghiên cứu PEG IFN α-2b , giảm liều ribavirin trong các trườnghợp phản ứng có hại liên quan đến ribavirin giảm từ 200- đến 400-mg
; trong PEG IFN α-2a, liều ribavirin giảm xuống 600 mg vì không dung nạp
Đáp ứng virus bền vứng xuất hiện 38.0% liều thấp nhóm PEG IFN α-2b; 39.8% liều chuẩn, liều đầy đủ nhóm PEG IFN α-2b; và 40.9% nhóm PEG IFN α-2a.
Viết tắt: PEG, polyethylene glycol; PEG IFN, pegylated interferon; HCV RNA, RNA virus viêm gan C.
BẢNG 164-4 CHỈ ĐỊNH VÀ KHUYẾN CÁO TRONG ĐIỀU TRỊ KHÁNG VIRUS VIÊM GAN C
Điều trị tiêu chuẩn
Phát hiện HCV RNA (kèm hoặc không ALT)
Xơ gan mức độ trung bình đến nặng trên sinh thiết gan
Khuyến cáo điều trị lại
Genotype 1 Tái phát, đáp ứng một phần, hoặc không đáp ứng sau một đợt điều trị IFN chuẩn đơn trị liệu hoặc kết hợp IFN chuẩn/ribavirin hoặc PEG IFN/ ribavirin
Một đợt dùng PEG-IFN/ribavirin với kháng protease và như sau
Genotype 2, 3, 4
Tái phát sau đơn trị liệu IFN tiêu chuẩn hoặc kết hợp IFN tiêu chuẩn/ribavirin
Điều trị một đợt IFN PEG với ribavirin
Không đáp ứng với điều trị IFN tiêu chuẩn đơn trị liệu hoặc kết hợp IFN tiêu chuẩn ribavirin
Một đợt điều trị PEG IFN với ribavirin— nhiều khả năng đã đạt được đáp ứng bền vững với virus ở bệnh nhân da trắng không có điều trị ribavirin trước đó, nồng độ HCV RNA nền thấp, kèm giảm 2-log10 HCV RNA trong suốt điều trị trước, với genotypes 2 and 3, và không kèm giảm liều ribavirin
Quyết định điều trị kháng virus trên cơ sở cá nhân
Trẻ em (tuổi <18 )—kháng protease không được khuyến cáo ở độ tuổi >60
Viêm gan nhẹ trên sinh thiết
Bệnh nhân có suy thận nặng
Khuyến cáo điều trị kéo dài
Viêm mạch Cryoglobulin huyết kèm viêm gan C mãn tính
Điều trị kéo dài ở nhóm không đáp ứng không được khuyến cáo
Điều trị kháng virus không được khuyến cáo
Xơ gan mất bù
Mang thai (gây quái thai ribavirin)
Chống chỉ định với thuốc
Phác đồ điều trị
HCV genotype 1
PEG IFN-α2a 180 μg mỗi tuần với ribavirin 1000 mg/d (cân nặng <75 kg) to 1200 mg/d (cân nặng ≥75 kg) hoặc
PEG IFN-α2b 1.5 μg/kg mỗi tuần với ribavirin 800 mg/d (Liều được sử dụng trong các thử nghiệm lâm sàng nhưng liều ribavirin phụ thuộc cân nặng được khuyến cáo cho cả 2 type PEG IFN)
Cộng với một chất kháng protease bao gồm một trong hai thuốc sau:
Boceprevir 800 mg 3 lần mỗi ngày bắt đầu sau điều trị 4 tuần với PEG IFN/ribavirin
• Bệnh nhân không phát hiện HCV RNA vào 8 và 24 tuần nên được nhận điều trị kết hợp 3 thuốc (PEG-IFN/ribavirin, boceprevir) 28 tuần. Nếu phát hiện HCV RNA ở tuần thứ 4, tiếp tục điều trị 48 tuần (4 tuần PEG IFN/ ribavirin sau đó 44 tuần kết hợp 3 thuốc) có thể làm tăng tỉ lệ kháng thuốc
• Bệnh nhân phát hiện HCV RNA ở tuần thứ 8, và không phát hiện ở tuần thứ 24 nên phối hợp điều trị 3 thuốc (PEG-IFN/ribavirin, boceprevir) trong 36 tuần ( 4 tuần PEG IFN/ ribavirin sau đó 32 tuần kết hợp 3 thuốc) sau đó lặp lại PEG IFN/ribavirin trong hơn 12 tuần, tốn thời gian điều trị 48 tuần
• Bệnh nhân xơ gan điều trị mới và không phát hiện HCV RNA tuần 8 và 24 nên kết hợp 3 thuốc (PEG IFN/ribavirin, boceprevir) trong 48 tuần (4 tuần PEG IFN/ ribavirin sau đó 44 tuần kết hợp 3 thuốc)
Telaprevir 750 mg 3 lần mỗi ngày bắt đầu điều trị không kèm PEG IFN/ribavirin
• Bệnh nhân không phát hiện HCV RNA vào tuần 4 và 12 nên điều trị phối hợp 3 thuốc (PEG IFN/ribavirin, telaprevir) trong 12 tuần sau đó PEGIFN và ribavirin trong 12 tuần nữa, tổn cộng 24 tuần
• Bệnh nhân xơ gan mới điều trị không phát hiện HCV RNA ở tuần 4 và 12 nên nhận điều trị phối hợp 3 thuốc trong 12 tuần sau đó PEG-FN, ribavirin trong 36 tuần nữa, tổng cộng 48 tuần
HCV genotype 1 ở nơi không sẵn kháng protease hoặc có chống chỉ định – điều trị trong 48 tuần
PEG IFN-α2a 180 μg hằng tuần với ribavirin 1000 mg/d (cân nặng <75 kg) tới 1200 mg/d ( cân nặng≥75 kg) hoặc
PEG IFN-α2b 1.5 μg/kg hằng tuần với ribavirin 800 mg/d (liều được sử dụng trong thử nghiệm lâm sàng, nhưng cao hơn, liều ribavirin theo cân nặng trên được khuyến cáo cho cả 2 type PEG IFN)
HCV genotype 4— điều trị 48 tuần
PEG IFN-α2a 180 μg hằng tuần với ribavirin 1000 mg/d (cân nặng <75 kg) tới 1200 mg/d (cân nặng ≥75 kg) hoặc
PEG IFN-α2b 1.5 μg/kg hằng tuần với ribavirin 800 mg/d (liều được sử dụng trong các thử nghiệm lâm sàng, nhưng cao hơn, liều ribavirin theo cân nặng trên được khuyến cáo cho cả 2 type PEG IFN)
• Nên ngừng điều trị ở bệnh nhân không đạt đáp ứng virus sớm ở tuần thứ 12
• Bệnh nhân đạt đáp ứng virus sớm nên được kiểm tra lại ở tuần 24 và nên ngừng điều trị nếu HCV RNA vẫn dương tính
HCV genotypes 2 và điều trị 3–24 tuần
PEG IFN-α2a 180 μg mỗi tuần với ribavirin 800 mg/d hoặc
PEG IFN-α2b 1.5 μg/kg mỗi tuần với ribavirin 800 mg/d (ở bệnh nhân genotype 3 xơ gan tiến triển và/ hoặc mức HCV RNA cao, nên điều trị đấy đủ 48 tuần)
Đối với bệnh nhân nhiễm đồng thời HCV-HIV : 48 tuần, bất kỳ kiểu gen nào, điều trị hằng tuần PEG IFN-α2a (180 μg) và PEG IFN-α2b (1.5 μg/kg) với liều ribavirin hằng ngày ít nhất 600–800 mg, hay phụ thuộc vào cân nặng 1000- to 1200-mg nếu dung nạp được. Kháng protease genotype I không được khuyến cao trong quần thể này hiện nay do có khả năng tương tác với các thuốc kháng HIV
Các đặc điểm liên quan đến giảm đáp ứng
Single-nucleotide polymorphism (SNP) T allele (trái với C allele) ở IL28B locus Genotype 1
Mức độ HCV RNA cao (>2 million copies/mL hoặc >800,000 IU/mL)
Xơ gan tiến triển
Bệnh kéo dài
Tuổi >40
Chủng biến đổi HCV cao
Suy giảm miễn dịch
Người Mỹ gốc Phi
Dân tộc Latino
Béo phì
Gan nhiễm mỡ
Kháng insulin, đái tháo đương type II
Không tuân thủ điều trị (giảm liều thuốc và giảm thời gian điều trị)
Viết tắt ALT, alanine aminotransferase; HCV, virus viêm gan C; IFN, interferon; PEG IFN, pegylated interferon; IU, đơn vi quốc tế (1 IU/mL tương đương với ~2.5 copies/mL).
Giám sát HCV RNA huyết hữu ích trong đánh giá đáp ứng điều trị. Mục đích điều trị là loại bỏ HCV RNA, tiên lượng bằng không xuất hiện HCV RNA bằng phản ứng chuỗi polymerase 6 tháng sau ngừng điều trị (đáp ứng virus duy trì). Điều trị thất bại khi giảm 2-log HCV RNA vào tuần 12 của điều trị không chắc chắn liệu pháp khác sẽ mang lại kết quả đáp ứng virus
bền vững. Do đó, khuyến cáo kiểm tra HCV RNA ở tuần 4,12 và 24 để đánh giá điều trị và hỗ trợ trong thời sau điều trị sau 12 tuần. Bệnh nhân genotype I nhận boceprevir nên kiểm tra HCV RNA thêm ở tuần 8, điều này có thể ảnh hưởng đến thời gian điều trị. Các ý kiến hiện nay đồng thuận rằng điều trị có thể chấm dứt nếu không đạt được đáp ứng virus sớm
VIÊM GAN A
Mặc dù viêm gan A hiếm khi gây viêm gan tối cấp, thường gặp hơn ở bệnh nhân bệnh gan mãn tính – đặc biệt viêm gan B hoặc C. Vaccine viêm gan A kích thích miễn dịch và dung nạp tố ở bệnh nhân viêm gan mãn tính. Do đó bệnh nhân bệnh gan mãn, đặc biệt viêm gan B hoặc C nên tiêm vaccine phòng viêm gan A
VIÊM GAN TỰ MIỄN
PHÂN LOẠI
Type I: Phân loại viêm gan tự miễn,kháng thể kháng tế bào cơ trơn và/ hoặc kháng thể kháng nhân (ANA). Type II: liên quan đến kháng thể kháng microsomal ở thận/gan (anti-LKM) chúng kháng trực tiếp cytochrome P450IID6 (chủ yếu gặp ở miền Nam châu Âu ). Type III bệnh nhân thiếu ANA và anti-LKM, phản ứng kháng thệ với cytokeratin tế bào gan, lâm sàng giống type I. Tiêu chuẩn chuẩn đoán được đề xuất bởi các tổ chức quốc tế.
BIỂU HIỆN LÂM SÀNG
Phân loại viêm gan tự miễn (type I): 80% phụ nữ, trong thập kỉ thứ 3 đến thứ 5. Khởi phát đột ngột (viêm gan cấp) chiếm 1/3, diễn biến âm thầm 2/3 : vàng da tiến triển, chán ăn, gan to, đau bụng, chảy máu cam, sốt, mệt mỏi, mất kinh. Dẫn tới xơ gan; >50% chết sau 5 năm nếu không được điều trị.
BIỂU HIỆN NGOÀI GAN
Phát ban, đau khớp, khô mắt, viêm tuyến giáp, thiếu máu tan huyết, viêm thận
BẤT THƯỜNG HUYẾT THANH
Tăng gamma globuline huyết, yếu tố dạng thấp dương tính, kháng thể kháng cơ trơn (40–80%), ANA (20–50%), kháng thể kháng ty nạp thể (10– 20%), anti-HCV enzym miễn dịch dương tính giả, nhưng thường không HCV RNA, p-ANCA không điểu hình. Type II: Kháng thể kháng -LKM .
Điều trị Viêm gan tự miễn
Chỉ định khi có triệu chứng, sinh thiết gan viêm gan mãn tính nghiêm trọng (hoại tử cầu nối), aminoftranferase tăng đáng kể ( gấp 5 – 10 lần), và tăng gamma globuline huyết. Prednisone hoặc prednisolone 30 -60 mg/ ngày uống giảm liều tới 10 -15 mg/ngày trong một vài tuần; thường azathioprine 50mg/ ngày uống cũng được cho phép với liều glucocorticoid và tránh các tác dụng phụ của steroid
Theo dõi xét nghiệm chức năng gan hằng tháng. Các triệu chứng có thể cải thiện nhanh, nhưng cải thiện sinh hóa ó thể mất vài tuần hoặc vài tháng tiếp theo cải thiện mô học (tổn thương viêm gan mãn tính nhẹ, hoặc sinh thiết bình thường) mất 18-24 tháng. Nên điều trị liên tục trong ít nhất 12 -18 tháng. Tái phát xuất hiện ít nhất 50% các trường hợp (tái điều trị). Trong các trường hợp tái phát, cân nhắc điều trị duy trì với liều glucocorticoid thấp hoặc azathioprim 2 (mg/kg)/ ngày


