ĐẠI CƯƠNG
Dị dạng động – tĩnh mạch não (AVM) là tổn thương mạch máu biểu hiện bằng các đám rối mạch, trung tâm là một ổ di dạng (nidus), tại đó máu từ động mạch đổ thẳng sang tĩnh mạch, khônci qua lưới mao mạch thông thường. Morris và cộng sự cho rằng quá trình bệnh lý này là do bấm sinh, phát triển thầm lặng trong bào thai và thời niên thiếu. Biểu hiện lâm sàng là các triệu chứng: đau đâu mạn tính, cơn co giật động kinh, biến chứng thường gặp là chảy máu não. AVM không phải là ung thư hay u mạch, nhưng cần phân biệt với thông động tĩnh mạch (arteriovenous fistula – AVF). Điều trị dị dạng động – tĩnh mạch não hiện nay có thể theo một trong 3 phương pháp: điều trị phẫu thuật, xạ phẫu hay can thiệp nội mạch (một số trường hợp phải phối hợp nhiều biện pháp điều trị).
Dịch tễ học
Tỷ lệ gặp dị dạng động – tĩnh mạch rất dao động, tùy theo nghiên cứu của mỗi tác giả, thường chiêm khoảng 1/7 tỉ lệ của các phình mạch nội sọ hay khoảng 0,14% dân số. Theo số liệu thông báo tại Scotland, AVM gặp ở khoảng 15/100.000 dân; theo AI – Shahiand Warlow (2001), Bermanetal (2000), Jellinger (1986) thì tỉ lệ gặp khoảng 400 – 600/100.000. Tại Hà Lan, tỷ lệ AVM có triệu chứng Ịà 1,1/100.000 dân mỗi năm (Jessurunet el al, 1993). Trong một nghiên cứu lâm sàng qua hồ sơ y tế hơn 27 năm từ 1965 – 1972 tại Olmsted County (Hoa Kỳ), tỉ lệ AVMs có triệu chứng là 1,84/100.000 dân mỗi năm. Dựa trên cơ sở này, mỗi năm tại Hoa Kỳ có khoảng 280.000 người có biểu hiện lâm sàng điển hình hoặc kín đáo AVM. Theo số liệu của nhiều trung tâm nghiên cứu về phình mạch não thấy mỗi năm có khoảng 2.400 bệnh nhân cần được chăm sóc y tế do AVM. Ngoại trừ các dị dạng tĩnh mạch Galen, các dị dạng động – tĩnh mạch ít khi gây ra triệu chứng lâm sàng trong thập kỷ đầu tiên, thường biểu hiện từ thập kỷ thứ hai đến thập kỷ thứ ba của cuộc đời. Tỷ lệ gặp ở nam và nữ ngang nhau.
Giải phẫu, sinh lý và chuyển hoá
Giải phẫu và ứng dụng lâm sàng
Cấu tạo một AVM gồm 3 thành phần: động mạch nuôi, ổ dị dạng và tĩnh mạch dẫn lưu. Đặc điểm nổi bật là máu từ động mạch đổ thẳng sang hệ tĩnh mạch thông qua các shunt mà không đi qua lưới mao mạch thông thường. Một cấu trúc bất thường khác cũng rất quan trọng trong nghiên cứu về AVM đó là phình mạch kết hợp với AVM. Các thành phần cấu tạo trên có liên quan đến triệu chứng lâm sàng, nguy cơ biến chứng chảy máu và phương pháp điều trị AVM.
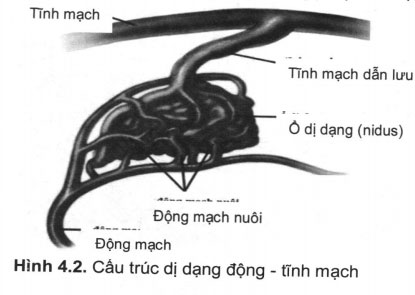
Động mạch nuôi: mỗi AVM thường được cấp máu từ một hay nhiều động mạch, thông thường động mạch nuôi AVM được hình thành từ bào thai, vì vậy, lưu lượng dòng máu qua đây cao hơn động mạch khác, máu chủ yếu đi qua khối dị dạng mà không làm nhiệm vụ chuyển hóa cho tổ chức não. Một số ít động mạch vừa nuôi ổ dị dạng vừa cấp máu cho một vùng tổ chức não (động mạch chức năng), đặc điểm này gây khó khăn cho công tác điêu trị. Trên động mạch nuôi có thể kết hợp các phình động mạch não, phình mạch gân gôc động mạch được gọi là phình mạch gần, gần ổ dị dạng gọi là phình mạch xa. Khi gặp trường hợp này thì nguy cơ chảy máu tăng lên. ứng dụng trong điều trị các trường hợp này cần xử trí phình mạch trước và AVM sau, nếu xử trí AVM trước sẽ làm tăng lưu lượng và áp lực máu lên phình mạch sẽ gây vỡ phình mạch.
Ổ dị dạng (nidus): ổ dị dạng là trung tâm của khối dị dạng, tại đây có sự thông thương giữa động mạch và tĩnh mạch qua một hệ thống shunt phức tạp. Những tổn thương này thường nằm sâu trong chất trắng, thành của các mạch máu dãn rộng, mỏng và không có cơ trơn hoặc tổ chức chun dãn. Hay gặp hiện tượng hyalin hoá hoặc vôi hoá, côt hoá ở các dị dạng lớn (trên hình ảnh chụp cắt lớp thấy tăng tỉ trọng dạng khảm trai), với cấu trúc đa dạng và phong phú tùy thuộc từng bệnh nhân, ổ dị dạng có nhiều kích cỡ khác nhau, dựa vào kêt quả chụp mạch số hóa (DSA) người ta thường chia các AVM làm 2 loại: kích thước lớn với đường kính ổ dị dạng > 3cm, kích thước nhỏ < 3cm. Có cách phân chia khác làm 3 mực độ: nhỏ ắ 3cm, vừa 3 – 6cm, lớn > 6cm. Trong ổ dị dạng có thể xuất hiện các phình mạch kêt hợp đây là nguy cơ gây chảy máu cao. Khi điều trị bằng phương pháp can thiệp nút dị dạng bằng keo (glue) cần đưa microcatheter vào trung tâm khối dị dạng.
Tĩnh mạch dẫn lưu: mỗi AVM có thể có 1 hay nhiều tĩnh mạch dẫn lưu, tĩnh mạch dẫn lưu có thể đổ vào hệ tĩnh mạch nông hoặc hệ tĩnh mạch sâu. Những AVM dẫn lưu về hệ tĩnh mạch sâu có nguy cơ chảy máu cao hơn dẫn lưu về hệ tĩnh mạch nông, một số trường hợp có thể thấy tĩnh mạch dẫn lưu bị dãn rộng hoặc chít hẹp. Trường hợp tĩnh mạch dẫn lưu bị chít hẹp có nguy cơ chảy máu cao.
Sinh lý và chuyển hóa
Năm 1928, Cushing và Pandi đã mô tả sự biến đổi của dòng máu bình thường vùng tổ chức não quanh các dị dạng động tĩnh mạch. Các tác giả đã cho rằng não không dùng dòng máu này cho mục đích chuyển hoá. Dòng máu đến và đi từ các dị dạng động tĩnh mạch được truyền qua các mạch máu có vị trí bình thường. Sự giảm áp lực dọc động mạch nuôi tỉ lệ thuận với vận tốc trung bình thời gian của dòng máu và chiều dài của động mạch. Do đó dòng máu đến chỗ dị dạng động tĩnh mạch càng cao thì áp lực trong các động mạch nuôi càng thấp. Áp lực máu tĩnh mạch vùng dị dạng động – tĩnh mạch tăng cũng dẫn đến sự giảm dòng máu nuôi dưỡng.
Mặc dù nhiều ổ dị dạng động – tĩnh mạch có cung lượng cao, biểu thị sự cướp máu não, nhưng không phải tất cả chúng đều gây triệu chứng thiếu máu. Đó là do cơ chế tự điều hoà của hệ thống mạch máu não nói chung (hiệu ứng Bayllis).
BỆNH CĂN, BỆNH SINH
- Theo nhiều công trình nghiên cứu, các tác giả cho rằng AVM là những khuyết tật bẩm sinh. Các nghiên cứu về phôi thai học hệ mạch máu não gợi ý cho ta hai loại dị dạng động tĩnh mạch:
Loại thứ nhất: phát sinh từ sự phát triển khác thường của các động mạch, tĩnh mạch, màng mạch nguyên thuỷ và các xoang tĩnh mạch gần đó. Các mạch máu này phát triển thành một mạch tắt trực tiếp từ động mạch vỏ não đến xoang tĩnh mạch ở gần đường giữa. Những tổn thương này thường biểu hiện như một tĩnh mạch của AVM.
Loại thứ hai: hay gặp hơn, do sự nảy sinh nối bất thường giữa đám rối động mạch và tĩnh mạch nguyên thuỷ phủ trên bề mặt vỏ não, phình mạch này trở thành một phần của vùng não đó. Do tuần hoàn nguyên thuỷ của vỏ não, màng cứng, da đầu và xương sọ là thống nhất nên tuần hoàn này liên quan đến việc tưới máu cho các tổ chức nêu trên.
PHÂN ĐỘ DỊ DẠNG ĐỘNG – TĨNH MẠCH
Phân độ trong dị dạng động – tĩnh mạch nhằm 2 mục đích: đánh giá nguy cơ chảy máu và để tiến hành điều trị.
- Theo Spetzler và Martin (1986) phân chia AVM thành các độ như sau:
+ Theo kích thước AVM:
Nhỏ: < 3cm -1 điểm.
Trung bình: 3 – 6cm – 2 điểm.
Lớn: >6 cm – 3 điểm.
+ Theo vị trí:
- Vùng không chức năng: 0 điểm.
- Vùng chức năng: 1 điểm + Theo tĩnh mạch dẫn lưu
- Đổ về tĩnh mạch nông: 0 điểm.
- Đổ về tĩnh mạch sâu: 1 điểm.
Tĩnh mạch dẫn lưu sâu là các tĩnh mạch dẫn lưu vào tĩnh mạch não trong, tĩnh mạch nền hoặc tĩnh mạch tiểu não trước trung tâm. Phân độ AVM được tính bởi tổng điểm của 3 tiêu chí trên.
- Theo Natat và cộng sự (1998), với mục đích giúp cho tiên lượng tai biến chảy máu trong can thiệp chia AVMs thành các độ sau:
+ Độ I: không có yếu tố nguy cơ:
- IA: có thêm một tĩnh mạch dẫn lưu.
- IB: không có thêm tĩnh mạch dẫn lưu.
+ Độ II: hẹp tĩnh mạch hoặc tĩnh mạch hồi lưu.
+ Độ III: thoát tĩnh mạch sâu chỉ.
+ Độ IV: phình mạch nằm trong hoặc lân cận ổ dị dạng (nidus)
Nguy cơ chảy máu: 13% với độ IA, 38% với độ IB, 48% độ II và 90% với độ III và IV.
LÂM SÀNG
Theo Morris, các triệu chứng lâm sàng thường biểu hiện ờ đầu thập niên thứ ba của cuộc đời, cũng có khi biểu hiện ờ thập niên thứ sáu, hiếm khi ở tuổi thiếu niên. Bệnh nhân thường đi khám bệnh và điều trị vì một hoặc nhiều lý do sau đây: đau đầu dai dẳng, đôi lúc có những cơn kịch phát, cơn co giật động kinh, chảy máu não hoặc chảy máu dưới nhện, xuất hiện các triệu chứng thần kinh khu trú, tổn thương các chức năng cao cấp của vỏ não. Có trường hợp bệnh nhân và thầy thuốc khám bệnh nghe thấy tiếng thổi ờ tai, mắt, đầu bệnh nhân.
Đau đầu
Đau đầu mạn tính là những triệu chứng thường gặp trong AVM. Theo Mastet và cộng sự (1995) đau đầu chiếm 7% – 48%, trung bình là 31% các trường hợp số bệnh nhân bị AVM. Đạu đầu thường xuất hiện ở thập kỷ thứ hai của cuộc đời, đau lan toả hoặc một bên đầu, đau đầu liên tục hay từng cơn, ít liên quan đến vị trí của AVM.
Động kinh
Động kinh là triệu chứng đầu tiên thường gặp trong AVM chiếm 16% – 53% số bệnh nhân, trung bình là 34% (Mastet và cs, 1995). Phần lớn các trường hợp là động kinh cục bộ hoặc cục bộ toàn thể hóa (Osipovet và cs, 1997). Những AVM ở vỏ não thường gắn liền với những co giật. Một số lượng lớn các trường hợp dùng thuốc chống động kinh có thể kiểm soát tốt các cơn co giật.
Co giật động kinh ở bệnh nhân AVM, không phụ thuộc vào lứa tuổi. Hơn 50% bệnh nhân được phát hiện có AVMs bị ít nhất một cơn động kinh cho đến lúc 30 tuổi. Động kinh là triệu chứng đầu tiên ở lứa tuổi 11 – 20. Chảy máu não – màng não hay gặp lứa tuổi 21 – 30 . Tỷ lệ động kinh cao gấp 2 lần so với chảy máu não. Trong một nghiên cứu của Phạm Đình Đài và Nguyễn Minh Hiện từ 2/2003 đến 6/2005, trên 39 bệnh nhân chảy máu não không có tiền sử tăng huyết áp. Tất cả các bệnh nhân trong nhóm nghiên cứu đều được chụp DSA để xác định nguyên nhân; trong đó nguyên nhân do vỡ AVM chiếm 63,6%, nhóm nghiên cứu có độ tuổi dưới 50 chiếm 82%, trong đỏ tuổi dưới 30 chiếm 51,3%, tiền sử động kinh chiếm 12,8%, co giật khi khởi phát chiếm 18%, tiền sử đã chảy máu não 20,5%.
Chảy máu não hoặc chảy máu dưới nhện
AVM vỡ thường gây ra chảy máu não thùy. Đặc điểm của chảy máu do vỡ AVM là chảy máu ở vùng vỏ não, hay tái phát, nếu cấp cứu thành công bệnh nhân thường phục hồi lâm sàng tốt. Một số trường hợp gây chảy máu não thất, chảy máu dưới nhện hoặc chảy máu kết hợp. Tỷ lệ gây chảy máu dưới nhện thấp hơn so với nguyên nhân vỡ phình động mạch não. Đây là điểm khác với phình mạch não chủ yếu gây chảy máu dưới nhện. Triệu chứng thần kinh khu trú xuất hiện do chảy máu phụ thuộc vào vị trí và kích thước của ổ máu tụ. Tiền triệu rất mơ hồ, bệnh khởi phát đột ngột với triệu chứng đau đầu dữ dội; kèm theo cứng gáy, nôn, dấu hiệu Kernig (+) và có thể sốt.
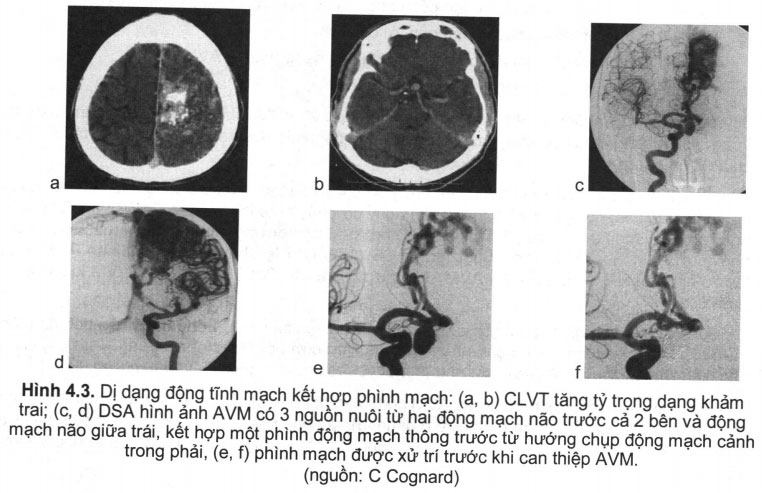
- Nguy cơ chảy máu não: kích thước AVM nhỏ, hệ thống tĩnh mạch dẫn lưu kém có nguy cơ chảy máu cao. AVMs kết hợp với phình mạch nguy cơ chảy máu cao hơn AVM đơn thuần. Theo Cognard c, tỷ lệ chảy máu não trong AVM dao động từ 2,7% – 22,7%, trung bình khoảng 10%.
- Phình mạch kết hợp với dị dạng động tĩnh mạch có 4 loại liên quan đến khối AVM:
+ Loại I: phình mạch nằm trên đoạn gốc động mạch nuôi ổ dị dạng (nidus) AVM.
+ Loại II: nằm trên động mạch đoạn gần tới ổ AVM.
+ Loại III; phình mạch nằm lân cận hoặc trong ổ dị dạng (nidus) AVM.
+ Loại IV: phình mạch không liên quan đến AVM.
Phân loại này nhằm nói lên nguy cơ chảy máu do vỡ AVM, phình mạch càng gần hoặc lẫn trong ổ dị dạng thì nguy cơ chảy máu càng cao. Để đánh giá nguy cơ chảy máu các tác giả còn chia độ như sau:
+ Kích thước AVM có liên quan đến nguy cơ chảy máu, kích thước càng nhỏ càng có nguy cơ chảy máu cao, ngược lại kích thước lớn nguy cơ chảy máu thấp. Theo Grafet và cs (1983), nguy cơ chảy máu trong vòng 5 năm là 10% cho AVM lớn (đường kính > 3,0cm), 52% cho AVM nhỏ (đường kính <3cm). Theo Spetzler và cs (1992), tỷ lệ chảy máu là 82% số AVM kích thước nhỏ (dưới 3 cm), 29% với AVM kích thước vừa (3 – 6cm), và 12% với AVM kích thước (trên 6cm).
+ Mối liên quan giữa kích thước ổ dị dạng với tỷ lệ chảy máu trong các phân tích đa biến thực hiện trong số lượng lớn bệnh nhân được nghiên cứu bởi Mansmannet và cs (2000) cũng xác định kích thước AVM dưới 3cm như là một yếu tố nguy cơ gây chảy máu nội sọ.
Tóm lại nguy cơ chảy máu do vỡ AVM gồm: ổ dị dạng nhỏ, dị dạng kết hợp với phình mạch (nhất là phình mạch nằm trong hoặc kề ổ dị dạng), dị dạng nằm ở sâu với ít tĩnh mạch dẫn lưu hoặc dẫn lưu kém. Tuy nhiên, nguy cơ tuyệt đối của chảy máu nội sọ từ AVM não nhỏ và lớn vẫn còn là một vấn đề tranh luận.
Các triệu chứng khác
Các thiếu sót thần kinh biểu hiện chủ yếu là triệu chứng thần kinh khu trú theo Mast và cs 1995, dao động từ 1% – 40%, các triệu chứng này không liên quan đến biến chứng chảy máu não. Nguyên nhân chính được cho là thiếu máu do hiện tượng “cướp máu não” của AVM với tổ chức não xung quang ổ dị dạng, lý do thứ 2 có thể là do hiệu ứng khối (mass effect), biểu hiện có sự chèn đẩy đường giữa và não thất bên, hay gặp ở những bệnh nhân có AVMs lớn, tĩnh mạch dẫn lưu dãn rộng. Hiệu ứng khối được phát hiện ở một tỷ lệ tương đối cao của các trường hợp không có biến chứng chảy máu, theo Miyasaka và cs (1997) gặp 44%.
Các triệu chứng ít gặp hơn như tim to, suy tim mạn tính do tăng cung lượng, tràn dịch não tắc nghẽn, tràn dịch não thông thường, chèn ép dây thần kinh sọ và chảy máu từ các phình mạch tạo thành từ các động mạch nuôi. Các triệu chứng này một phần liên quan với lứa tuổi bệnh nhân. Tim to và suy tim chỉ gặp trong thời nhũ nhi và thập kỷ đầu của cuộc sống ở những bệnh nhân bị AVM dãn tĩnh mạch Gallen. Tràn dịch não tắc nghẽn hay gặp do tĩnh mạch Gallen bị dãn, chèn ép vào cống lưu thông dịch não tuỷ hoặc do hậu quả của chảy máu não thất.
Việc khám xét lâm sàng cần chú ý lứa tuổi bị bệnh. Đối tượng trẻ nhũ nhi cần phát hiện triệu chứng tim tặng động, đo chu vi đầu, soi đáy mắt phát hiện ứ phù gai thị. cần chú ý nghe ờ đâu phát hiện tiếng thổi để giúp chẩn đoán định khu. Khám lâm sàng phát hiện triệu chứng tổn thương thần kinh khu trú xác định vị trí chảy máu của AVM.
Ngày nay với sự tiến bộ của các kỹ thuật chẩn đoán hình ảnh không xâm nhập, nhiều tổn thương trên được phát hiện một cách ngẫu nhiên.
CHẨN ĐOÁN HÌNH ẢNH
Mục đích của chẩn đoán hình ảnh: chẩn đoán AVM, đánh giá trước điều trị, quyết định phương pháp điều trị can thiệp nội mạch đơn thuần hoặc kết hợp với phẫu thuật hoặc xạ phẫu, đánh giá sau điều trị.
Chụp cắt lớp vi tính
- Với AVM chưa vỡ: CLVT (chụp cắt lớp vi tính) là xét nghiệm cần thiết để phát hiện một AVMs ở bệnh nhân đau đầu, động kinh hoặc có triệu chứng thần kinh khu trú. Hình ảnh AVM trên phim CLVT là ổ tăng tỉ trọng, đỏng vôi dạng khảm trai (hình 4.3a) ở các thùy não vùng vỏ não thùy trán, thái dương, đỉnh. Trên phim CLVT có bơm thuốc cản quang có thể thấy rõ vùng AVM ngoằn ngoèo, đặc biệt với MSCLVT (chụp cắt lớp vi tính đa dãy) có phần mềm 3D cho phép chẩn đoán chính xác AVM. Trường hợp nghi ngờ có AVM thì lựa chọn CHT (chụp cộng hưởng từ), MRA (chụp cộng hưởng từ sọ não) là cần thiết để đánh giá tổn thương.
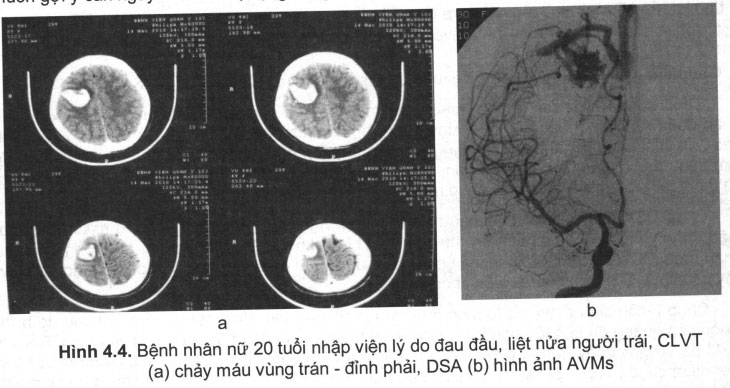
- Trường hợp AVM đã vỡ: CLVT luôn được lựa chọn đầu tiên, trên hình ảnh chụp cắt lớp vi tính nếu thấy tăng tỷ trọng ờ một thùy não, có thể thấy hình ảnh của chảy máu dưới nhện hoặc chảy máu não thất. Các thùy não hay gặp là thùy đỉnh, chẩm, thái dương. Vì vậy trước một hình ảnh chảy máu não thùy trên một bệnh nhân trẻ tuổi, không có tiền sử tăng huyết áp luôn gợi ý căn nguyên do vỡ dị dạng động tĩnh mạch (hình 4.4).
Cộng hưởng từ, chụp cộng hưởng từ mạch (magnetic resonance imaging, magnetic mesonance angiography – CHT, MRA)
Hình ảnh AVMs trên CHT được mô tả như dạng tổ ong tăng tín hiệu cả trên trên T1 và T2, tăng ngấm thuốc mạnh khi tiêm thuốc đối quang từ. Trên MRA đặc biệt với xung TOF – 3D có thể phát hiện rõ nét hình ảnh AVM (Hình 4.5).
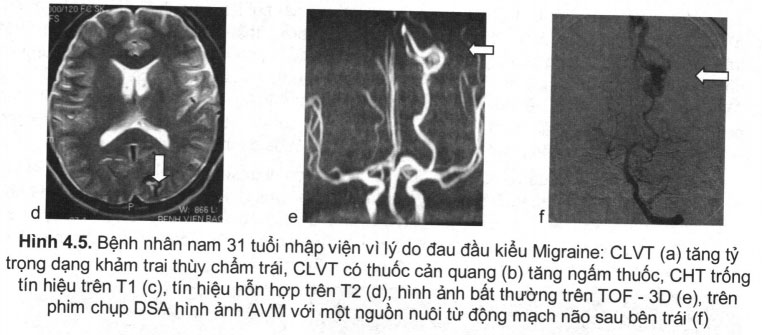
Chụp động mạch não số hóa xóa nền (digital subtraction angiography – DSA)
Chụp động mạch cản quang hoặc chụp mã hoá xoá nền là tiêu chuẩn vàng để xác định chẩn đoán ẠVM. Với bất kỳ một dị dạng động tĩnh mạch nào khi chụp DSA đều cần xác định các tính chất sau: kích thước ổ dị dạng, xác định nguồn động mạch nuôi, tĩnh mạch dẫn lưu để làm tiền đề cho việc cân nhắc có can thiệp hay không;. Hiện nay với kỹ thuật hiện đại người ta có thể tích hợp hình ảnh từ máy chụp mạch với hệ thống xạ trị gama knife.
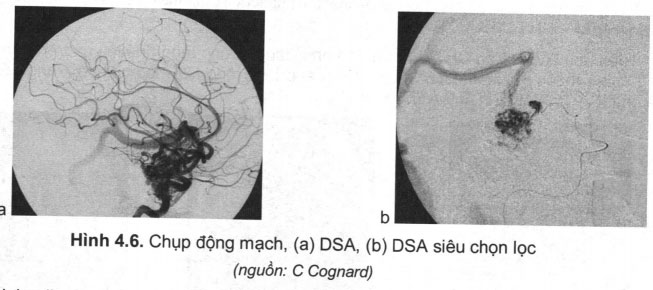
Chụp DSA cần phải chụp ở các tư thế: thẳng, nghiêng và xoay để bộc lộ rõ tổn thương, mặc dù vậy việc bộc lộ rõ nét tổn thương đôi khi rất khó khăn ngay cả khi hệ thống chụp có phần mềm 3D xoay, nhất là khi chảy máu não, ổ máu tụ che lấp hoặc đè ép các mạch máu vì vậy cần chụp DSA mạch máu siêu chọn lọc.
Chụp mạch siêu chọn lọc là luồn một microcatheter vào động nuôi khối AVM sau đó bơm thuốc cản quang để bộc lộ chọn lọc tổn thương nhất là ổ dị dạng, phình mạch kết hợp. Đối với AVM đã vỡ gây chảy máu, kỹ thuật này là cần thiết nhất là khi tiến hành can thiệp mạch cùng thời điểm chụp (hình 4.6). Nhược điểm là có nguy cơ cao vỡ tái phát, nhất là khi có phình mạch kết hợp nằm trong hoặc lân cận ổ dị dạng (nidus).
Tóm lại, mặc dù chụp mạch cộng hưởng từ hoặc chụp CLVT sọ não có thể phát hiện được AVM, nhưng để xác định mạch máu đến và đi đồng thời tìm tổn thương do sự cung cấp máu cho vùng não xung quanh vẫn cần phải chụp động mạch. Một AVM có thể có một hoặc nhiều nguồn động mạch hướng tâm. Vì vậy, nên chụp cả 2 hệ động mạch (hệ động mạch cảnh, hệ đốt sống – thân nền). Tĩnh mạch dẫn lưu của AVM có thể là hệ thống tĩnh mạch sâu, nông hoặc trực tiếp đổ vào một xoang lớn.
CHẨN ĐOÁN, CHẨN ĐOÁN PHÂN BIỆT
Chẩn đoán dựa vào các triệu chứng lâm sàng đã mô tả ở trên và chụp CLVT sọ não, CLVT đa dãy, CHT, MRA, DSA.
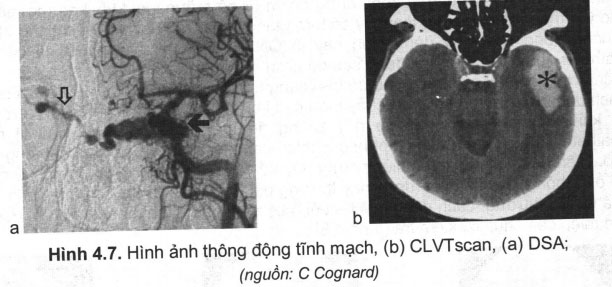
Chẩn đoán phân biệt với chảy máu não do thông động tĩnh mạch (arteriovenuos fistula — AVF). AVF là sự thông thương giữa động mạch và tĩnh mạch, máu từ động mạch đổ trực tiếp vào tĩnh mạch, làm tĩnh mạch phình to và dãn rộng (hiện tượng động mạch hóa tĩnh mạch), mà không có ổ bệnh (nidus) như AVMs (hình 4.7).
 ĐIỀU TRỊ
ĐIỀU TRỊ
- Nhờ có sự phát triển của các kỹ thuật chẩn đoán hình ảnh và kinh nghiệm của các nhà ngoại khoa và can thiệp thần kinh. Đến nay, các tác giả đã cho rằng việc điều trị AVM được tiến hành bắng các phương pháp sau:
+ Phẫu thuật.
+ Xạ phẫu.
+ Can thiệp nội mạch.
Các phương pháp này bổ sung và hỗ trợ lẫn nhau cho kết quả cao. cần phát hiện sớm AVM và điều trị phẫu thuật để loại bỏ nguy cơ chảy máu não – màng não, giảm tỷ lệ tử vong và tàn phế. Các yếu tố được cân nhắc trong việc phẫu thuật AVM gồm : kích thước ổ tổn thương, số lượng động mạch nuôi, lưu lượng qua tổn thương, mức độ cướp máu từ các mô nặo xung quanh, vị trí tổn thương, tầm quan trọng chức năng của mô não xung quanh và hệ thống dẫn lưu tĩnh mạch.
- Phương pháp điều trị phẫu thuật là mở sọ cắt bỏ khối AVM, nếu có máu tụ do vỡ thì kết hợp lấy máu tụ giải phóng chèn ép não. Theo Spetzler – Martin (1986) tỷ lệ tử vong do phẫu thuật khoảng 1% và tỷ lệ tàn tật dưới 12%. Phẫu thuật thuận lợi 92% -100%, tùy theo mức độ: độ I là 95%, độ II là 88%, độ III là 73%, độ IV và độ V là 57%. Những vùng được coi là không có chỉ định phẫu thuật như đồi thị, thân não, phần gần đường giữa các bán cầu và vùng cạnh não thất.
- Phương pháp can thiệp nội mạch bằng cách sử dụng các chất gây tắc mạch, chủ yếu là keo sinh học (glue). vấn đề này còn nhiều tranh luận ở rất nhiều lý do từ chỉ định, biến chứng, năng lực của các nhà can thiệp, khả năng ứng phó với các tai biến của các ở sở điều trị còn nhiều vấn đề chưa thống nhất. Mục đích của điều trị tắc mạch phòng ngừa chảy máu hoặc chảy máu tái phát đối với AVM đã vỡ, việc cải thiện các triệu chứng lâm sàng khó chữa như: co giật, thương tổn thần kinh, đau đầu. Can thiệp cần được tiến hành ờ các trung tâm có đội ngũ chuyên gia có thể làm được can thiệp, bệnh nhân cần được theo dõi, chăm sóc đặc biệt sau can thiệp. Bệnh nhân thường được gây mê trong quá trình can thiệp. Nếu có phình mạch kết hợp với AVM nhất là phình mạch nằm trên động mạch nuôi AVM thì cần xử trí phình mạch trước khi xử trí AVM (hình 4.3).
– Kỹ thuật can thiệp: luồn một microcatheter vào trung tâm ổ bệnh (nidus) qua guiding được đưa vào từ động mạch đùi phải. Sau độ bơm keo làm tắc các shunt thông xóa bỏ AVM. Phương pháp này có nhiều ưu điểm: ít xâm lấn, hiệu quả cao với AVM kích thước nhỏ (đường kính dưới 3 cm). Có 2 loại keo gây tắc: loại đông cứng nhanh Histoacryl được pha với lipiodol tỷ lệ từ 17% đên 20%, 25%, hoặc 33%. Loại này đông cứng gần như ngay lập tức khi bơm ra khỏi microcatheter, vì vậy, ngay sau khi bơm keo cần rút ngay lập tức microcatheter khỏi tổn thương tránh dính. Do vậy, histoacryl thường được sử dụng làm tắc cho AVM nhỏ, có một mạch nuôi, vị trí làm tắc là tiểu động mạch trước ổ dị dạng hoặc động mạch nuôi AVM. Loại thứ 2 cũng thường được sử dụng là đông cứng chậm từ bề mặt ngoài khối keo (nơi tiếp xúc của khôi keo với thành lòng mạch), loại này có thời gian đông cứng hoàn toàn khoảng 30 phút sau bơm, thông dụng nhất hay dùng hiện nay là ONỴX. Với loại này người ta cần đưa đầu microcạtheter vào trung tâm ổ dị dạng sau đó bơm rất chậm và quan sát (hình 4.8). Điều quan trọng cần bơm keo đầy ổ dị dạng sau đó tràn sang tĩnh mạch dẫn lưu, tuyệt đối không bơm tắc tĩnh mạch dân lưu trước vì nguy cơ chảy máu cao khi làm tắc tĩnh mạch dẫn lưu trước. Một lưu ý khác khi sử dụng phương pháp này không để keo trào ngược từ đầu vi ống thông (microcatheter) theo động mạch về phía gốc microcatheter nguy cơ sẽ dính đầu ống thông vào khối keo. Hiện nay để khắc phục biến chứng này đã có loại ống thông có đoạn đầu có thể tách rời khỏi ống thông khi cần thiết (đoạn này thường dài 2cm). Trước khi can thiệp cần chụp DSA đánh giá kỹ tổn thương, cách động mạch nuôi,ổ bệnh (nidus), tĩnh mạch dẫn lưu, trước khi kết thúc can thiệp cần chụp lại kiểm tra (hình 4.8).
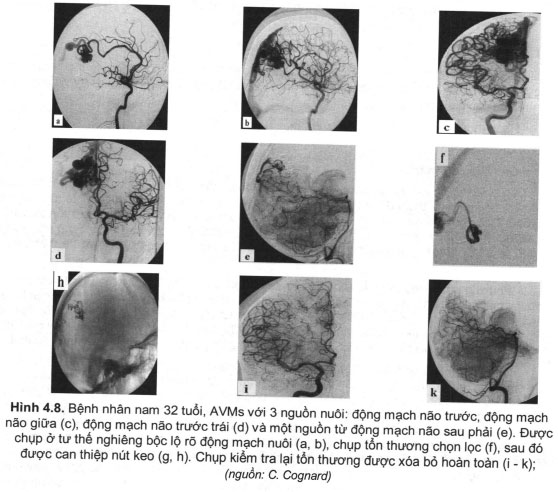
+ Biến chứng chính của phương pháp này là: dính đầu vi ống thông với khối keo vừa được bơm tắc, vỡ ống thông, chảy máu não, tắc mạch não nhất là động mạch vừa nuôi AVMs vừa nuôi tổ chức não.
– Phương pháp điều trị bằng xạ phẫu: đã trở thành một phương pháp điều trị chủ yếu đối với các AVM. Tỷ lệ loại bỏ hoàn toàn AVM phụ thuộc kích thước ổ dị dạng trung bình là 55%. Tương quan VỚI kích thước: 77% cho ổ <15rrim, 62% cho ổ từ 15mm – 25mm, 44% cho ổ > 25mm. Tỷ lệ tử vong 1,6%, chủ yếu do chảy máu tái phát, chảy máu tái phát xảy ra ở 6,5% số trường hợp xạ trị. Tỷ lệ chảy máu tái phát là 2,98%/năm. Loạn thần và thiêu hụt thân kinh liên quan đến xạ và không liên quan tới xuất huyết đã được quan sát thấy ở 5,37% sô trường hợp, tổn thương thần kinh vĩnh viễn ở 1,46% theo Natafet và cs (2000). Tỷ lệ biến chứng theo Hiệp hội Đột quỵ Hoa Kỳ ước tính có 5% – 7% nguy cơ biến chứng liên quan đến điều trị với xạ, ngoài ra nguy cơ chảy máu là 3% – 4% mỗi năm. Trong khoảng thời gian 3 năm có 14% -19% có nguy cơ biến chứng xuất huyết.
TIẾN TRIỂN VÀ TIÊN LƯỢNG
Chảy máu nội sọ là biến chứng nặng nề nhất của AVM. Biến chứng chạy máu thứ phát của AVM cũng rất thường gặp đôi khi ảnh hưởng đến tính mạng bệnh nhân. Rất khó xác định nguy cơ chảy máu từ một AVM. Một AVM chưa vỡ có nguy cơ chảy máu hàng năm là 4%. Tỷ lệ tử vong do lần chảy máu đầu tiên từ 6-14%. Tỉ lệ chảy máu tái phát khoảng 6% cho năm đầu, 2 – 4% cho những năm tiếp theo.


